Let’s talk about LDTs
Durch das Inkrafttreten der Europäischen Verordnung für In-vitro-Diagnostika ist die Dokumentation für die Nutzung von In-house IVDs in medizinischen Einrichtungen im Artikel 5 geregelt. Zudem gilt der Anhang I als Checkliste für die einzelnen Kapitel in der In-house IVD-Akte. Diese Akte ist für jedes einzelne Reagenz (oder Software) anzulegen, das außerhalb der Zweckbestimmung verwendet wird.
Die nachfolgende Abbildung gibt einen Überblick über die zu bearbeitenden Arbeitspakete und strukturiert sie zugleich:
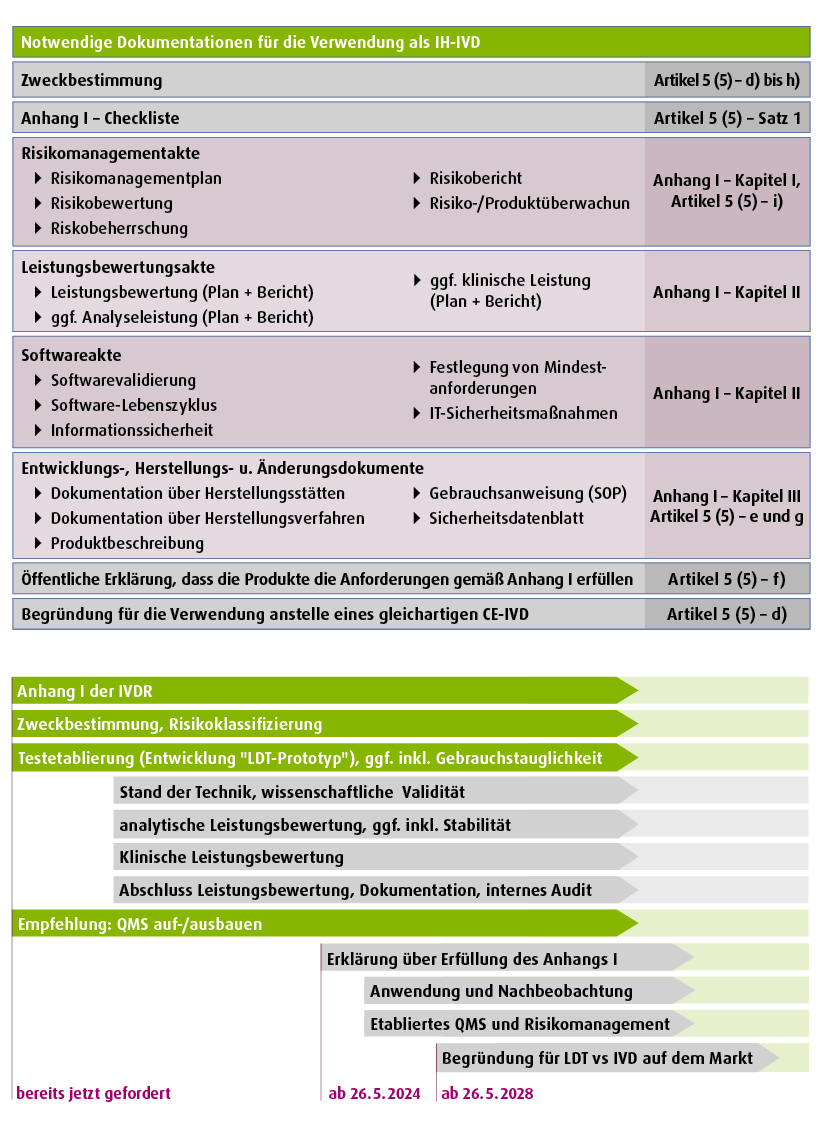
Die Abbildung zeigt die notwendige Dokumentation für die Nutzung eines In-house-In-vitro-Diagnostikums (IH-IVD) in Gesundheitseinrichtungen mit dem Bezug zur Europäischen Verordnung für In-vitro-Diagnostika (IVDR, grün). Diese Dokumente treffen nicht zwingend für alle Produkte zu und sind ggf. auch nicht vollständig. (aus: Kahles A et al. Struktur und Inhalt der EU-IVDR, Die Pathologie Vol 43 351–364, 2022)
Eine sorgsame und genaue Beschreibung der Zweckbestimmung dient Ihnen als gutes Gerüst für die Erstellung der jeweiligen In-house IVD-Akte.
Sprechen Sie uns an! Im Rahmen unserer IHC-Workshops informieren wir Sie gern über nebenstehende und weitere Anforderungen an Sie als Hersteller von LDTs.
Gerne können Sie auch unseren FAQ-Katalog zur IVDR-Thematik bei uns anfordern. Darin geben wir auf relevante Fragen detaillierte Antworten.
Kontaktieren Sie uns unter immunhistochemie@zytomed-systems.de.
Ihr Produktmanagement-Team
Immunhistochemie



